réservé à la recherche
Anti-DYKDDDDK Tag magnetic beads
Les Anti-DYKDDDDK Tag magnetic beads sont basées sur des billes magnétiques hydroxylées couplées de manière covalente à un anticorps monoclonal de souris recombinant de haute qualité. Avec une charge élevée de protéines marquées DYKDDDDK (plus de 0,6 mg de protéines/mL) et une spécificité élevée, il est recommandé de les utiliser pour la co-immunoprécipitation et la purification des protéines.

De Selleck A été cité par 119 Publications
Avantages
Gain de temps : économisez 15 à 30 minutes par rapport aux billes dagarose.
Opération simple : Séparation magnétique et sans centrifugation.
Capacité de chargement de protéines élevée.
Haute spécificité.
Comparaison de produits
Description
Les Anti-DYKDDDDK Tag magnetic beads sont basées sur des billes magnétiques hydroxylées couplées de manière covalente à un anticorps monoclonal de souris recombinant de haute qualité. Avec une charge élevée de protéines marquées DYKDDDDK (plus de 0,6 mg de protéines/mL) et une spécificité élevée, il est recommandé de les utiliser pour la co-immunoprécipitation et la purification des protéines.
Propriétés
| Isotype danticorps | Anticorps monoclonal de souris recombinant |
|---|---|
| Purification de lanticorps | Purifié par la protéine A |
| Application | Immunoprécipitation et purification des protéines |
| Volume recommandé | IP : 20 μl de billes pour 200 μl de solution protéique brute |
| Capacité de liaison | Minimum 0,6 mg de protéines éluées par ml de billes magnétiques |
| Caractéristiques de liaison | Protéine de fusion Met-N-terminal DYKDDDDK Tag : Met-DYKDDDDK Tag–Protéine Protéine de fusion N-terminal DYKDDDDK Tag : DYKDDDDK Tag–Protéine Protéine de fusion C-terminal DYKDDDDK Tag : Protéine-DYKDDDDK Tag |
Stockage (à partir de la date de réception)
Conserver à 2-8°C pendant 2 ans.
Protocole
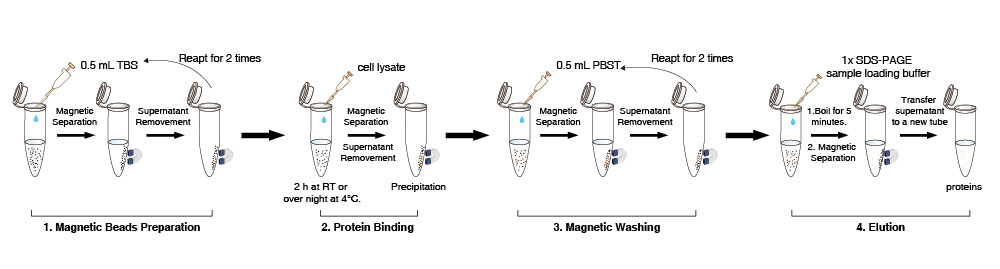
Préparation des billes magnétiques
1. Suspendre les Anti-DYKDDDDK Tag magnetic beads dans le flacon (pipeter doucement 10 fois, ne pas vortexer). Transférer 10 µL (la quantité peut être augmentée ou diminuée selon les besoins) de suspension dAnti-DYKDDDDK Tag Magnetic Beads dans un nouveau tube.
2. Ajouter 0,5 mL de tampon TBS (50 mM Tris HCl, 150 mM NaCl, pH 7,4). Pipeter doucement 5 fois les Anti-DYKDDDDK Tag magnetic beads. Placer le tube sur laimant pour séparer les billes de la solution pendant 1-2 min (peut être prolongé de manière appropriée à 5 minutes) et retirer le surnageant. Répéter cette étape 2 fois.
Remarque : Préparer toutes les billes magnétiques ensemble dans un grand tube, puis les diviser en aliquots si les échantillons sont traités par lots. Lors du retrait du surnageant, aspirer doucement, car une aspiration excessive peut entraîner la perte de certaines billes magnétiques.
Liaison des protéines
3. Ajouter 500 µL de lysat cellulaire aux billes magnétiques lavées. Faire tourner doucement le tube pendant 2 h à température ambiante ou toute la nuit à 4°C.
4. Placer le tube sur laimant pour séparer les billes de la solution pendant 1-2 min (peut être prolongé de manière appropriée), puis transférer le surnageant dans un nouveau tube pour détecter si la protéine marquée DYKDDDDK est résiduelle.
Remarque : Pendant le processus de liaison, le résultat ne sera pas affecté si les billes magnétiques sagglomèrent occasionnellement.
Lavage magnétique
5. Ajouter 500 µL de PBST au tube (NaCl 136,89 mM ; KCl 2,67 mM ; Na2HPO4 8,1 mM ; KH2PO4 1,76 mM ; 0,5% Tween20), resuspendre les billes magnétiques en pipetant doucement. Faire ensuite tourner le tube pendant 5 min. Placer le tube sur laimant pour séparer les billes de la solution pendant 10 sec et retirer le surnageant.
6. Répéter létape 5 environ 2 fois. Si des protéines dimpuretés non spécifiques subsistent, prolonger le temps de nettoyage, augmenter le nombre de nettoyages ou augmenter proportionnellement la teneur en détergent dans la solution de nettoyage.
Élution et détection
Choisir différentes méthodes délution en fonction de lutilisation en aval. Pour lIP, passer aux étapes 7-8. Pour la purification des protéines, passer aux étapes 9-10 pour lélution à pH faible.
Élution dénaturante (convient aux expériences dIP utilisant des billes Anti-DYKDDDDK Tag) :
7. Pour la détection directe des protéines cibles, ajouter 50 µL de tampon de charge déchantillon de protéines 1× dans la précipitation mentionnée ci-dessus, faire bouillir pendant 5 min, refroidir à température ambiante, puis placer le tube sur laimant pour séparer les billes de la solution pendant 1-2 min (peut être prolongé de manière appropriée).
8. Détecter le surnageant par SDS-PAGE.
Élution compétitive du polypeptide poly DYKDDDDK Tag (Convient aux purifications de protéines par les billes Anti-DYKDDDDK Tag) :
9. Ajouter le tampon TBS avec 200 µg-1 mg/mL de Poly DYKDDDDK Tag Peptide (B23111) au produit de létape 6, puis les incuber sur agitateur (4°C) pendant 2 h. Généralement, le volume de Poly DYKDDDDK Tag Peptide est 5 fois celui du gel.
10. Placer les produits de létape ci-dessus sur le séparateur magnétique pour la séparation magnétique. Transférer le surnageant contenant la protéine cible dans un nouveau tube EP. Si les billes magnétiques doivent être réutilisées, nettoyer le gel avec 0,1 M glycine HCl (pH 3,0) et effectuer le recyclage.
Élution à faible pH (Convient à la purification des protéines par les billes Anti-DYKDDDDK Tag) :
11. Ajouter le tampon délution de 0,1 M glycine HCl (pH 3,0) au produit de létape 6, et incuber sur agitateur pendant 5 min (Le temps délution doit être inférieur à 20 min). Généralement, le volume du tampon délution est 5 fois celui du gel.
12. Centrifuger les produits obtenus à létape ci-dessus à 5000 tr/min pendant 30 sec. Transférer ensuite rapidement le produit délution dans 1 M Tris (pH 8,0) pour neutralisation jusquà ce que le pH soit proche de la neutralité.
Dépannage
| Problème | Cause possible | Amélioration suggérée |
|---|---|---|
| Fond élevé | Liaison non spécifique des protéines à lanticorps, aux billes magnétiques ou aux tubes EP | Pré-clarifier le lysat pour éliminer les protéines de liaison non spécifiques. Après avoir suspendu les billes pour le lavage final, transférer léchantillon entier dans un tube EP propre, puis effectuer une séparation magnétique. |
| Les temps de lavage ne sont pas suffisants. | Augmenter le nombre de lavages. Augmenter la durée des lavages. |
|
| Aucun signal nest observé. | La protéine marquée DYKDDDDK nest pas exprimée dans léchantillon. | Sassurer que la protéine dintérêt contient la séquence du tag DYKDDDDK. Préparer le lysat frais. Utiliser des inhibiteurs de protéase appropriés. |
| Les temps dincubation sont insuffisants. | Augmenter les temps dincubation. | |
| Une substance interférente est présente dans léchantillon. | Le lysat peut contenir des concentrations élevées de dithiothréitol (DTT), de 2-mercaptoéthanol ou dautres agents réducteurs. Une concentration excessive de détergent peut interférer avec linteraction anticorps-antigène. |
Téléchargement de fichier
Autres produits connexes
Support technique
Si vous avez dautres questions, veuillez laisser un message.
